一、藥品注冊申請
藥品注冊,是指國家食品藥品監督管理局根據藥品注冊申請人的申請,依照法定程序,對擬上市銷售的藥品的安全性、有效性、質量可控性等進行系統評價,并決定是否同意其申請的審批過程。
藥品注冊申請的類別

資料來源:智研咨詢整理
二、藥品注冊申請審評審批現狀
1、藥品注冊申請審評審批相關政策法規
新藥研發是激發藥品產業發展的重要源動力,國家陸續出臺了系列藥品審評審批制度的改革政策以鼓勵藥物創新,尤其新版《藥品管理法》強調藥品全生命周期管理,將研制與注冊獨立成為專章,建立上市許可持有人制度,極大強化了新藥研發環節。
藥品注冊申請審評審批相關政策法規
日期 | 頒布部門 | 行業政策法規 | 概述 |
2017年 | 食品藥品監管總局 | 《關于鼓勵藥品創新實行優先審評審批的意見食藥監藥化管〔2017〕126號》 | 為加強藥品注冊管理,加快具有臨床價值的新藥和臨床急需仿制藥的研發上市,解決藥品注冊申請積壓的矛盾。 |
2017年 | 國家藥品監督管理局 | 《關于發布藥品注冊受理審查指南(試行)的通告(2017年第194號)》 | 為落實《國務院關于改革藥品醫療器械審評審批制度的意見》(國發〔2015〕44號),根據《關于調整藥品注冊受理工作的公告》(2017年第134號)要求,國家食品藥品監督管理總局組織制定了藥品注冊受理審查指南(試行)。 |
2017年 | 食品藥品監管總局 | 《關于調整藥品注冊受理工作的公告(2017年第134號)》 | 依據《國務院關于改革藥品醫療器械審評審批制度的意見》(國發〔2015〕44號),為建立審評主導的藥品注冊技術體系,實現以審評為核心,現場檢查、產品檢驗為技術支持的審評審批機制,國家食品藥品監督管理總局研究決定自2017年12月1日起,將現由省級食品藥品監督管理部門受理、國家食品藥品監督管理總局審評審批的藥品注冊申請,調整為國家食品藥品監督管理總局集中受理。 |
2018年 | 國家藥品監督管理局、國家衛生健康委員 | 《關于臨床急需境外新藥審評審批相關事宜的公告(2018年第79號)》 | 為落實國務院常務會議有關會議精神,加快臨床急需的境外上市新藥審評審批,國家藥品監督管理局會同國家衛生健康委員會組織起草了《臨床急需境外新藥審評審批工作程序》及申報資料要求。 |
2018年 | 國家藥品監督管理局 | 《關于調整藥物臨床試驗審評審批程序的公告(2018年第50號)》 | 為鼓勵創新,加快新藥創制,滿足公眾用藥需求,落實申請人研發主體責任,依據中共中央辦公廳、國務院辦公廳《關于深化審評審批制度改革鼓勵藥品醫療器械創新的意見》(廳字〔2017〕42號),對藥物臨床試驗審評審批的有關事項作出調整:在我國申報藥物臨床試驗的,自申請受理并繳費之日起60日內,申請人未收到國家食品藥品監督管理總局藥品審評中心(以下簡稱藥審中心)否定或質疑意見的,可按照提交的方案開展藥物臨床試驗。 |
2018年 | 國家藥品監督管理局 | 《關于發布古代經典名方中藥復方制劑簡化注冊審批管理規定的公告(2018年第27號)》 | 為貫徹落實《中華人民共和國中醫藥法》《國務院關于改革藥品醫療器械審評審批制度的意見》(國發〔2015〕44號),傳承發展中醫藥事業,國家藥品監督管理局會同國家中醫藥管理局組織制定了《古代經典名方中藥復方制劑簡化注冊審批管理規定》。 |
2018年 | 國家藥品監督管理局、國家衛生健康委員 | 《關于優化藥品注冊審評審批有關事宜的公告(2018年第23號)》 | 為貫徹落實《中共中央辦公廳國務院辦公廳關于深化審評審批制度改革鼓勵藥品醫療器械創新的意見》(廳字〔2017〕42號)、《國務院關于改革藥品醫療器械審評審批制度的意見》(國發〔2015〕44號),提高創新藥上市審批效率,科學簡化審批程序。進一步落實藥品優先審評審批工作機制,對防治嚴重危及生命且尚無有效治療手段疾病以及罕見病藥品,國家食品藥品監督管理總局藥品審評中心(以下簡稱藥審中心)建立與申請人之間的溝通交流機制,加強對藥品研發的指導,對納入優先審評審批范圍的注冊申請,審評、檢查、審批等各環節優先配置資源,加快審評審批。 |
2018年 | 國家藥品監督管理局 | 《關于發布《關于加強藥品審評審批信息保密管理的實施細則》的通告(2018年第27號)》 | 為維護藥品注冊申請人的合法權益,規范和加強審評審批信息保密管理,確保藥品審評審批工作合法高效運行,根據《中華人民共和國藥品管理法》《中共中央辦公廳國務院辦公廳印發〈關于深化審評審批制度改革鼓勵藥品醫療器械創新的意見〉的通知》《國家食品藥品監督管理總局藥品醫療器械審評審批信息保密管理辦法》等,國家藥品監督管理局制定了《關于加強藥品審評審批信息保密管理的實施細則》。 |
2018年 | 國家藥品監督管理局 | 《關于加強化學仿制藥注射劑注冊申請現場檢查工作的公告(2018年第20號)》 | 自本公告發布之日起,對已由省級藥品監管部門受理并正在國家藥品監督管理局審評審批的化學仿制藥注射劑注冊申請,國家藥品監督管理局將加大有因檢查的力度,國家食品藥品監督管理總局藥品審評中心(以下簡稱藥審中心)在嚴格審評的基礎上,根據審評需要提出現場檢查需求,由國家食品藥品監督管理總局食品藥品審核查驗中心(以下簡稱核查中心)實施現場檢查。 |
2019年 | 全國人民代表大會常務委員會 | 《中華人民共和國藥品管理法》 | 為了加強藥品管理,保證藥品質量,保障公眾用藥安全和合法權益,保護和促進公眾健康,制定本法。 |
2019年 | 國家藥監局 | 《關于進一步完善藥品關聯審評審批和監管工作有關事宜的公告(2019年第56號)》 | 為落實中共中央辦公廳、國務院辦公廳《關于深化審評審批制度改革鼓勵藥品醫療器械創新的意見》,原食品藥品監管總局發布了《關于調整原料藥、藥用輔料和藥包材審評審批事項的公告》(2017年第146號),現就進一步明確原料藥、藥用輔料、直接接觸藥品的包裝材料和容器(以下簡稱原輔包)與藥品制劑關聯審評審批和監管有關事宜公告。 |
2020年 | 國家市場監督管理總局 | 《藥品注冊管理辦法》 | 為規范藥品注冊行為,保證藥品的安全、有效和質量可控,根據《中華人民共和國藥品管理法》(以下簡稱《藥品管理法》)、《中華人民共和國中醫藥法》、《中華人民共和國疫苗管理法》(以下簡稱《疫苗管理法》)、《中華人民共和國行政許可法》、《中華人民共和國藥品管理法實施條例》等法律、行政法規,制定本辦法。 |
2、審評審批完成情況
智研咨詢發布的《2021-2027年中國藥品行業發展現狀分析及投資策略研究報告》顯示:2020年國家藥審中心完成中藥(包括民族藥,下同)、化學藥、生物制品各類注冊申請審評審批共11582件(含器械組合產品4件,以受理號計,下同),較2019年增長32.67%(如無說明,以注冊申請件數計,下同)。其中,完成需技術審評的注冊申請8606件(含5674件需藥審中心技術審評和行政審批注冊申請),較2019年增長26.24%;完成直接行政審批(無需技術審評,下同)的注冊申請2972件。
2016-2020年中國藥品注冊申請審評審批完成情況(單位:件)
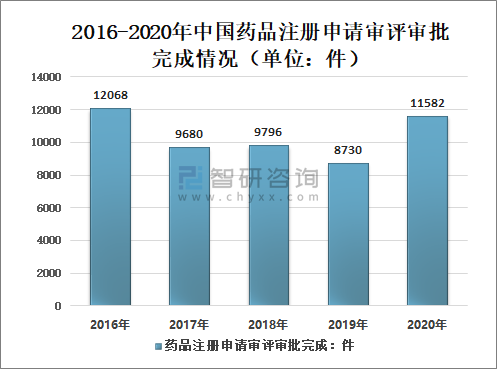
資料來源:國家藥審中心、智研咨詢整理
2020年國家藥審中心完成8606件需技術審評的藥品注冊申請,同比增長26.24%,其中:化學藥注冊申請為6778件,較2019年增長25.22%;中藥注冊申請418件,較2019年增長39.33%;生物制品注冊申請1410件,較2019年增長27.72%;化學藥注冊申請約占全部技術審評完成量的78.76%。
2016-2020年中國藥品注冊申請需技術審評完成情況(單位:件)

資料來源:國家藥審中心、智研咨詢整理
2016-2020年中國中藥、生物制品、化學藥注冊申請審評審批完成情況(單位:件)
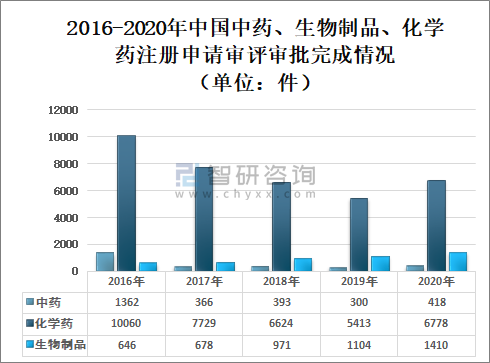
(注:1.完成總量中包含器械組合產品的注冊申請,故注冊申請完成總量大于中藥、化學藥、生物制品注冊申請完成量之和。2.藥審中心的直接行政審批工作自2017年開始,故2016年無直接行政審批的注冊申請,2016年的注冊申請均需技術審評。)
資料來源:國家藥審中心、智研咨詢整理
3、各類注冊申請審評完成情況
藥審中心完成需技術審評的8606件注冊申請中,完成新藥臨床試驗(IND)申請審評1561件,較2019年增長55.94%;完成新藥上市申請(NDA)審評289件,完成仿制藥上市申請(ANDA)審評1700件;完成仿制藥質量和療效一致性評價(以下簡稱一致性評價)申請(以補充申請途徑申報)1136件,較2019年增長103.22%;完成補充申請技術審評3250件,較2019年增長24.19%;難性臨床申請審評126件,較2019年增長0.8%;補充申請審評完成3250件,較2019年增長24.19%;境外生產藥品再注冊申請審評完成498件,較2019年下降10.91%;復審申請審評完成46件,較2019年增長70.37%。
2016-2020年中國各類注冊申請審評完成情況(單位:件)
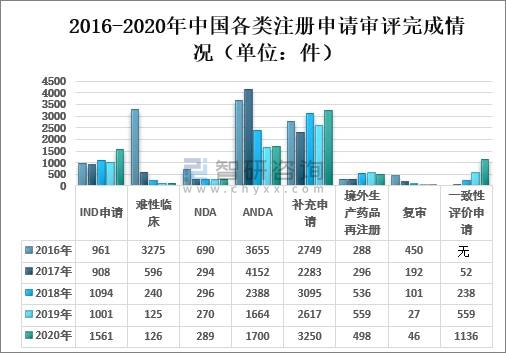
(注:藥審中心自2017年8月開始承擔仿制藥質量和療效一致性評價工作。)
資料來源:國家藥審中心、智研咨詢整理
4、審評通過情況
2020年國家藥審中心審評通過批準IND申請1435件,較2019年增長54.97%;審評通過NDA208件,較2019年增長26.83%;審評通過ANDA918件;審評通過批準一致性評價申請577件,較2019年增長121.92%。藥審中心審評通過創新藥NDA20個品種,審評通過境外生產原研藥品NDA72個品種(含新增適應癥品種)。
2019-2020年中國藥審中心審評通過批準IND、NDA、ANDA申請及審評通過批準一致性評價申請(單位:件)
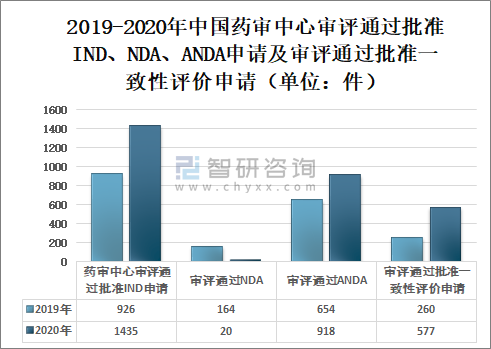
資料來源:國家藥審中心、智研咨詢整理
5、審結注冊申請任務按時限完成情況
2020年國家藥審中心持續優化審評流程,嚴格審評時限管理,加強項目督導,加快審評速度,整體審評任務和重點序列審評任務按時限完成率均取得顯著提升。
全年審結注冊申請任務整體按時限完成率為94.48%,其中臨床急需境外已上市新藥注冊申請審結任務整體按時限完成率為100%;按默示許可受理注冊申請的審結任務整體按時限完成率為99.87%;直接行政審批的注冊申請100%在法定的20個工作日內完成,且審批平均用時11.8個工作日;臨床急需境外已上市新藥審結任務整體按時限完成率100%;境外生產藥品再注冊審結任務整體按時限完成率97.99%;補充申請審結任務整體按時限完成率96.94%;一致性評價申請審結任務整體按時限完成率89.01%;ANDA審結任務整體按時限完成率76.77%;優先審評審結任務整體按時限完成率72.87%;NDA審結任務整體按時限完成率55.50%。
2020年中國各類注冊申請任務按時限完成情況
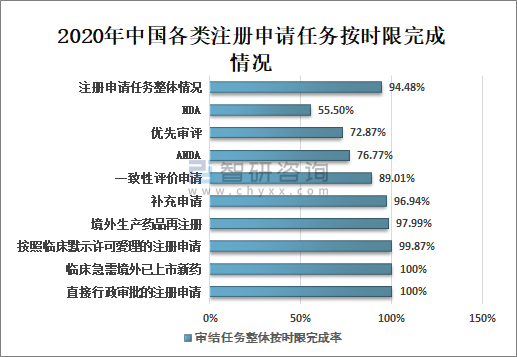
資料來源:國家藥審中心、智研咨詢整理
三、藥品注冊申請受理情況
1、藥品注冊申請受理
2016-2020年國家藥審中心藥品注冊申請受理數量呈增長態勢,2020年中國藥審中心受理中藥、化學藥、生物制品各類注冊申請共10245件(含藥械組合產品6件),較2019年增長26.76%。
2016-2020年中國藥品注冊申請受理情況(單位:件)
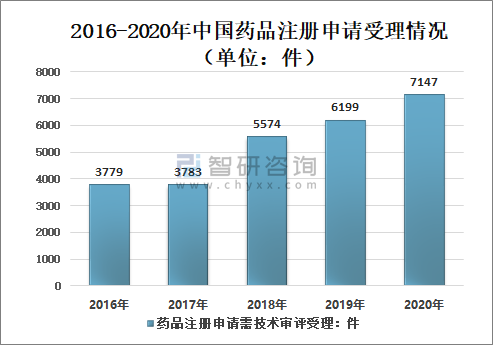
資料來源:國家藥審中心、智研咨詢整理
其中,需技術審評的注冊申請7147件(含5695件需藥審中心技術審評和行政審批的注冊申請),較2019年增長15.29%。
2016-2020年中國藥品注冊申請需技術審評受理情況(單位:件)
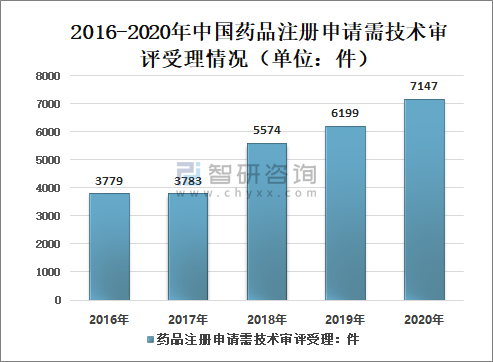
資料來源:國家藥審中心、智研咨詢整理
2020年國家藥審中心受理的10239件藥品注冊申請中,化學藥注冊申請受理量為7901件,較2019年增長22.02%,占2020年全部注冊申請受理量的77.17%;中藥注冊申請受理量為471件,較2019年增長11.35%,占2020年全部注冊申請受理量的4.60%;生物制品注冊申請受理量為1867件,較2019年增長58.35%,占2020年全部注冊申請受理量的18.23%;
2016-2020年中國各類藥品注冊申請受理情況(單位:件)
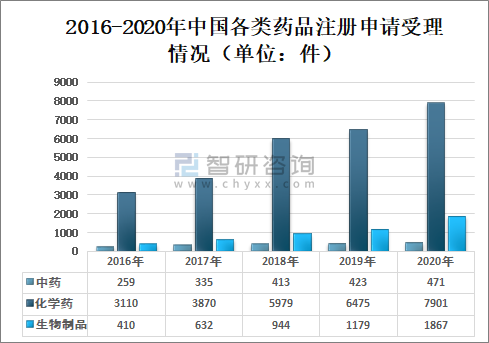
(注:1.2019-2020年受理量中含藥械組合產品的注冊申請,故上圖中2019-2020年受理注冊申請總量大于中藥、化學藥、生物制品受理注冊申請之和;2.藥審中心的直接行政審批工作自2017年開始,故2016年無直接行政審批注冊申請,所有受理注冊申請均需技術審評。)
資料來源:國家藥審中心、智研咨詢整理
2020年國家藥審中心受理的需技術審評的注冊申請7147件中,化學藥注冊申請為5402件,較2019年增長9.42%,占全部需技術審評的注冊申請受理量的75.58%;中藥注冊申請315件,較2019年增長22.57%;生物制品注冊申請1430件,較2019年增長42.29%。
2016-2020年需技術審評的中藥、化學藥、生物制品各類藥品注冊申請受理情況(單位:件)

資料來源:國家藥審中心、智研咨詢整理
2、行政審批注冊申請受理情況
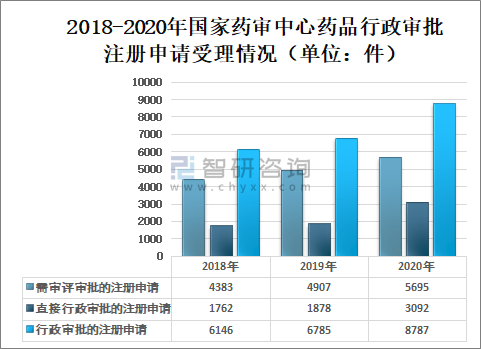
2020年國家藥審中心受理需中心行政審批的中藥、化學藥、生物制品各類注冊申請8787件,較2019年增長29.51%。其中,受理需審評審批的注冊申請(臨床試驗申請、一致性評價申請、補充申請、境外生產藥品再注冊及復審)5695件,較2019年增長16.06%;受理直接行政審批的注冊申請(無需技術審評的補充申請、臨時進口申請)3092件,較2019年增長64.64%。
2018-2020年國家藥審中心藥品行政審批注冊申請受理情況(單位:件)
資料來源:國家藥審中心、智研咨詢整理
2020年國家藥審中心藥品需審評審批的注冊申請受理數量5696件,其中:臨床試驗申請(含驗性臨床)行政審批注冊申請受理1618件;一致性評價申請行政審批注冊申請受理914件;補充申請行政審批注冊申請受理2827件;境外生產藥品再注冊行政審批注冊申請受理328件;復審行政審批注冊申請受理8件。直接行政審批的注冊申請受理數量3092件,其中:無需技術審評的補充申請行政審批注冊申請受理2644件;臨時進口申請行政審批注冊申請受理448件。
藥審中心受理3092件直接行政審批的注冊申請中,按申請類型劃分,補充申請2644件、臨時進口申請448件。
2020年國家藥審中心藥品行政審批注冊申請受理的具體情況
受理量 | 中藥 | 化學藥 | 生物制品 | 總計 | |
需審評審批的注冊申請受理數量 | 臨床試驗申請(含驗性臨床) | 22 | 1016 | 580 | 1618 |
一致性評價申請 | 0 | 914 | 0 | 914 | |
補充申請 | 271 | 1856 | 700 | 2827 | |
境外生產藥品再注冊 | 11 | 294 | 23 | 328 | |
復審 | 3 | 5 | 0 | 8 | |
直接行政審批的注冊申請受理數量 | 無需技術審評的補充申請 | 144 | 2124 | 376 | 2644 |
臨時進口申請 | 12 | 375 | 61 | 448 | |
總計 | 463 | 6584 | 1740 | 8787 | |
 智研咨詢 - 精品報告
智研咨詢 - 精品報告

2025-2031年中國心腦血管疾病用藥行業市場競爭現狀及發展潛力研判報告
《2025-2031年中國心腦血管疾病用藥行業市場競爭現狀及發展潛力研判報告》共六章,包含心腦血管疾病領域重點產品市場分析,心腦血管疾病領域重點企業分析,中國心腦血管用藥行業發展前景與投資機會分析等內容。

 公眾號
公眾號
 小程序
小程序
 微信咨詢
微信咨詢






















